ОПРЕДЕЛЕНИЕ
Никель - двадцать восьмой элемент Периодической таблицы. Обозначение - Ni от латинского «niccolum». Расположен в четвертом периоде, VIIIB группе. Относится к металлам. Заряд ядра равен 28.
Подобно кобальту, никель встречается в природе преимущественно в виде соединений с мышьяком или серой; таковы, например, минералы купферникель NiAs, мышьяковоникелевый блеск NiAsS и др. Никель более распространен, чем кобальт [около 0,01% (масс.) земной коры].
Металлический никель имеет серебристый цвет с желтоватым оттенком (рис. 1), очень тверд, хорошо полируется, притягивается магнитом. Он характеризуется высокой коррозионной стойкостью - устойчив в атмосфере, в воде, в щелочах и ряде кислот. Активно растворяется в азотной кислоте. Химическая стойкость никеля обусловлена его склонностью к пассивированию - к образованию на поверхности оксидных пленок, обладающих сильным защитным действием.
Рис. 1. Никель. Внешний вид.
Атомная и молекулярная масса никеля
ОПРЕДЕЛЕНИЕ
Относительной молекулярная масса вещества (M r) - это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (A r) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии никель существует в виде одноатомных молекул Ni, значения его атомной и молекулярной масс совпадают. Они равны 58,6934.
Изотопы никеля
Известно, что в природе никель может находиться в виде пяти стабильных изотопов 58 Ni, 60 Ni, 61 Ni, 62 Niи 64 Ni. Их массовые числа равны 58, 60, 61, 62 и 64 соответственно. Ядро атома изотопа никеля 58 Ni содержит двадцать восемь протонов и тридцать нейтронов, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные нестабильные изотопы никеля с массовыми числами от 48-ми до 78-ми, а также восемь мета стабильных состояний, среди которых наиболее долгоживущим является изотоп 59 Ni с периодом полураспада равным 76 тысяч лет.
Ионы никеля
Электронная формула, демонстрирующая распределение по орбиталям электронов никеля выглядит следующим образом:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 .
В результате химического взаимодействия никель отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Ni 0 -2e → Ni 2+ ;
Ni 0 -3e → Ni 3+ .
Молекула и атом никеля
В свободном состоянии никель существует в виде одноатомных молекул Ni. Приведем некоторые свойства, характеризующие атом и молекулу никеля:
Сплавы никеля
Главная масса никеля идет на производство различных сплавов с железом, медью, цинком и др. Металлами. Присадка никеля к стали повышает её вязкость и стойкость против коррозии.
Сплавы на основе никеля можно разделить на жаропрочные (нимоник, инконель, хастелла [свыше 60% никеля, 15-20% хрома и др. металлы]), магнитные (пермаллой ) и сплавы с особыми свойствами (монель-металл, никелин, константан, инвар, платинит).
Примеры решения задач
ПРИМЕР 1
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
NiCl 2 → Ni → NiSO 4 → Ni(NO 3) 2 → Ni(OH) 2 → NiCl 2 . Уравнения реакций, протекающих в растворах, изобразите в ионной и сокращенной ионной формах. |
| Ответ | Поместив в раствор хлорида никеля (II) более активный, чем никель металл, можно получить никель в свободном виде (реакция замещения):
NiCl 2 + Zn → Ni + ZnCl 2 ; Ni 2+ + Zn 0 → Ni 0 + Zn 2+ . Никель растворяется в разбавленной серной кислоте с образованием сульфата никеля (II): Ni + H 2 SO 4 (dilute) → NiSO 4 + H 2 ; Ni 0 + 2H + → Ni 2+ + H 2 . Нитрат никеля (II) можно получить по реакции обмена: NiSO 4 + Ba(NO 3) 2 → Ni(NO 3) 2 + BaSO 4 ↓; SO 4 2- + Ba 2+ → BaSO 4 ↓. Подействовав на нитрат никеля (II) щелочью можно получить гидроксид никеля (II): Ni(NO 3) 2 + 2NaOH → Ni(OH) 2 ↓+ 2NaNO 3 ; Ni 2+ + 2OH — = Ni(OH) 2 ↓. Хлорид никеля (II) из гидроксида никеля (II) можно получить по реакции нейтрализации с соляной кислотой: Ni(OH) 2 + 2HCl → NiCl 2 + 2H 2 O; OH — + H + = H 2 O. |
ПРИМЕР 2
| Задание | Какую массу хлорида никеля (II) можно получить при нагревании 17,7 г никеля и 12 л хлора (н.у.)? Какой объем 0,06М раствора можно приготовить из этой массы соли? |
| Решение | Запишем уравнение реакции:
Ni + Cl 2 = NiCl 2 . Найдем количество моль никеля (молярная масса - 59 г/моль) и хлора, вступивших в реакцию используя данные указанные в условии задачи: n (Ni) = m (Ni) / M (Ni); n (Ni) = 17,7 / 59 = 0,3 моль. n (Cl 2) = V (Cl 2) / V m ; n (Cl 2) = 12 / 22,4 = 0,54 моль. Согласно уравнению задачи n (Ni): n (Cl 2) = 1:1. Это означает, что хлор находится в избытке и все дальнейшие расчеты следует вести по никелю. Найдем количество вещества и массу образовавшегося хлорида никеля (II) (молярная масса 130 г/моль): n (Ni): n (NiCl 2) = 1:1; n (Ni) = n (NiCl 2) = 0,3 моль. m (NiCl 2)= n (NiCl 2)×M (NiCl 2); m (NiCl 2)= 0,3 × 130 = 39 г. Рассчитаем объем 0,06М раствора, который можно получить из 39 г хлорида никеля (II): V(NiCl 2) = n (NiCl 2)/ c (NiCl 2); V (NiCl 2)= 0,3 / 0,06 = 0,5 л. |
| Ответ | Масса хлорида никеля (II) равна 39 г, объем 0,06М раствора - 0,5 л (500 мл). |
на тему: Никель и его свойства
Работу составили студенты 2 курса группы 5202
Никитин Дмитрий и Шархемуллин Эмиль.
Казань 2013г.
Физические свойства Никеля.
ЭлементБыл открыт в 1761г. Ни́кель - элемент десятой группы, четвёртого периода периодической системы химических элементовД. И. Менделеева, с атомным номером 28. Серебристо-белый металл, что не тускнеет на воздухе. В чистом виде весьма пластичен и поддается обработке давлением. Является ферромагнетиком, т.е. при проведении через него тока облядает ярко выраженными магнитными свойствами. Атомы никеля имеют внешнюю электронную конфигурацию 3d 8 4s 2 . Является ковким и тягучим металлом, что позволяет изготовлять из него тончайшие листы и трубки.
Химические свойства Никеля
В химические отношении Ni сходен с Fe и Со, но также и с Cu и благородными металлами. В соединениях проявляет переменную валентность (чаще всего 2-валентен). Никель - металл средней активности. Поглощает (особенно в мелкораздробленном состоянии) большие количества газов
Никель горит только в виде порошка. Образует при этом два оксида NiO и Ni 2 O 3 и соответственно два гидроксида Ni(OH) 2 и Ni(OH) 3 . Важнейшие растворимые соли никеля - ацетат, хлорид, нитрат и сульфат. Водные растворы солей окрашены обычно в зелёный цвет, а безводные соли - жёлтые или коричнево-жёлтые, что нередко используется в аналитической химии.
насыщение Н. газами ухудшает его механические свойства. Взаимодействие с кислородом начинается при 500 °С; в мелкодисперсном состоянии Н. пирофорен - на воздухе самовоспламеняется. Из окислов наиболее важна закись NiO - зеленоватые кристаллы, практически нерастворимые в воде (минерал бунзенит). Гидроокись выпадает из растворов никелевых солей при прибавлении щелочей в виде объёмистого осадка яблочно-зелёного цвета. При нагревании Н. соединяется с галогенами, образуя NiX 2 . Сгорая в парах серы, даёт сульфид, близкий по составу к Ni 3 S 2 . Моносульфид NiS может быть получен нагреванием NiO с серой. С азотом Н. не реагирует даже при высоких температурах (до 1400 °С)
В жидком состоянии Н. растворяет заметное количество С, выпадающего при охлаждении в виде графита. При выделении графита Н. теряет ковкость и способность обрабатываться давлением.
По отношению к воде никель устойчив. Органические кислоты действуют на Н. лишь после длительного соприкосновения с ним. Серная и соляная кислоты медленно растворяют Н.; разбавленная азотная - очень легко; концентрированная HNO 3 пассивирует Н., однако в меньшей степени, чем железо. При взаимодействии с кислотами образуются соли 2-валентного Ni. Почти все соли Ni (II) и сильных кислот хорошо растворимы в воде, растворы их вследствие гидролиза имеют кислую реакцию.
Комплексные соединения Никеля.
Связывание Никеля в комплексы- важный диагностические процесс, для аналитической химии.
Для никеля характерно образование комплексов. Так, катион Ni 2+ с аммиаком образует гексаамминовый комплекс 2+ и диакватетраамминовый комплекс 2+ . Эти комплексы с анионамиобразуют синие или фиолетовые соединения.
К нерастворимым солям относятся оксалат и фосфат (зелёная окраска), три сульфида: NiS (черный), Ni 3 S 2 (желтовато-бронзовый) и Ni 3 S 4 (серебристо-белый). Или, диметилглиоксимат никеля Ni(C 4 H 6 N 2 O 2) 2 , дающий чёткую красную окраску в кислой среде, что широко используется в качественном анализе для обнаружения никеля.
Водные растворы солей никеля(II) содержат ион гексаакваникеля(II) 2+ . При добавлении к раствору, содержащему эти ионы, аммиачного раствора происходит осаждение гидроксида никеля (II), зелёного желатинообразного вещества. Этот осадок растворяется при добавлении избыточного количества аммиака вследствие образования ионов гексамминникеля(II) 2+ .
Никель образует комплексы с тетраэдрической и с плоской квадратной структурой. Например, комплекс тетрахлороникелат (II) 2− имеет тетраэдрическую структуру, а комплекс тетрацианоникелат(II) 2− имеет плоскую квадратную структуру.
Характерна реакция ионов Ni 2+ с диметилглиоксимом, приводящая к образованию розово-красного диметилглиоксимата никеля. Эту реакцию используют при количественном определении никеля, а продукт реакции - как пигмент косметических материалов и для других целей.
Количественное определение Элемента.
Осуществляется в основном следующими методами:
1) Осаждением в виде диметоиглиоксимата никеля, как уже было сказано.
2) осаждением ввид еникель-альфа-бензилдиоксима.
3)Осаждение ввиде гидроокиси никеля(3) . Эта реакция проводится с помощью едкого кали и бромной воды.
4)Осаждение в виде сульфида. Где будет использован в качестве весовой формы оксид никеля2.
5)Электролитическим методом
6)Обьёмным методом - т.е титрование цианида калия до образования комплексного цианида(Калий 2 никель це эн четырежды)
7)Колометрический метод, основанный на изменении окраски иона гексаамминаникеля, или красного окрашивания растворимого комплексного соединения, что образуется при реакции ионов никеля 3 с диметилглиоксимом в щёлочном растворе в присутствии окислителя.
8)Комплексонометрическим методом.
ГРАВИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ НИКЕЛЯ Метод основан на осаждении никеля в аммиачном растворе диметилглиоксимом в виде малорастворимого внутрикомплексного соединения в присутствии лимонной или винной кислоты.
тИТРИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ НИКЕЛЯ
Метод основан на осаждении никеля в аммиачном растворе диметилглиоксимом в виде малорастворимого внутрикомплексного соединения в присутствии лимонной или винной кислоты и определении никеля комплексонометрическим титрованием с эриохром черным Т в качестве индикатора.
История
Никель (англ., франц. и нем. Nickel) открыт в 1751 г. Однако задолго до этого саксонские горняки хорошо знали руду, которая внешне походила на медную руду и применялась в стекловарении для окраски стёкол в зелёный цвет. Все попытки получить из этой руды медь оказались неудачными, в связи с чем в конце XVII в. руда получила название купферникель (Kupfernickel), что приблизительно означает «Медный дьявол». Руду эту (красный никелевый колчедан NiAs) в 1751 г. исследовал шведский минералог Кронштедт. Ему удалось получить зелёный окисел и путём восстановления последнего — новый металл, названный никелем. Когда Бергман получил металл в более чистом виде, он установил, что по своим свойствам металл похож на железо; более подробно никель изучали многие химики, начиная с Пруста. Никкел — ругательное слово на языке горняков. Оно образовалось из искажённого Nicolaus — родового слова, имевшего несколько значений. Но главным образом слово Nicolaus служило для характеристики двуличных людей; кроме того, оно обозначало «озорной маленький дух», «обманчивый бездельник» и т. д. В русской литературе начала XIX в. употреблялись названия николан (Шерер, 1808), николан (Захаров, 1810), николь и никель (Двигубский, 1824).
Физические свойства
Металлический никель имеет серебристый цвет с желтоватым оттенком, очень твёрд, вязкий и ковкий, хорошо полируется, притягивается магнитом, проявляя магнитные свойства при температурах ниже 340 °C.
Химические свойства
Дихлорид никеля (NiCl2)
Атомы никеля имеют внешнюю электронную конфигурацию 3d84s2. Наиболее устойчивым для никеля является состояние окисления Ni(II).
Никель образует соединения со степенью окисления +2 и +3. При этом никель со степенью окисления +3 только в виде комплексных солей. Для соединений никеля +2 известно большое количество обычных и комплексных соединений. Оксид никеля Ni2O3 является сильным окислителем.
Никель характеризуется высокой коррозионной стойкостью — устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию — образованию на его поверхности плотной оксидной плёнки, обладающей защитным действием. Никель активно растворяется в азотной кислоте.
С оксидом углерода CO никель легко образует летучий и весьма ядовитый карбонил Ni(CO)4.
Тонкодисперсный порошок никеля пирофорный (самовоспламеняется на воздухе).
Никель горит только в виде порошка. Образует два оксида NiO и Ni2O3 и соответственно два гидроксида Ni(OH)2 и Ni(OH)3. Важнейшие растворимые соли никеля — ацетат, хлорид, нитрат и сульфат. Растворы окрашены обычно в зелёный цвет, а безводные соли — жёлтые или коричнево-жёлтые. К нерастворимым солям относятся оксалат и фосфат (зелёные), три сульфида NiS (черный), Ni2S3 (желтовато-бронзовый) и Ni3S4 (черный). Никель также образует многочисленные координационные и комплексные соединения. Например, диметилглиоксимат никеля Ni(C4H6N2O2)2, дающий чёткую красную окраску в кислой среде, широко используется в качественном анализе для обнаружения никеля
Водный раствор сульфата никеля в банке имеет зелёный цвет.
Водные растворы солей никеля(II) содержат ион гексаакваникеля(II) 2+. При добавлении к раствору, содержащему эти ионы, аммиачного раствора происходит осаждение гидроксида никеля (II), зелёного желатинообразного вещества. Этот осадок растворяется при добавлении избыточного количества аммиака вследствие образования ионов гексамминникеля(II) 2+.
Никель образует комплексы с тетраэдрической и с плоской квадратной структурой. Например, комплекс тетрахлороникелат (II) 2− имеет тетраэдрическую структуру, а комплекс тетрацианоникелат(II) 2− имеет плоскую квадратную структуру.
В качественном и количественном анализе для обнаружения ионов никеля (II) используется щелочной раствор бутандиондиоксима, известного также под названием диметилглиоксима. При его взаимодействии с ионами никеля (II) образуется красное координационное соединение бис(бутандиондиоксимато)никель(II). Это — хелатное соединение и бутандиондиоксимато-лиганд является бидентатным.
Нахождение в природе
Никель довольно распространён в природе — его содержание в земной коре составляет ок. 0,01 %(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8 %). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2 кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13 — 0,41 % Ni. Он изоморфно замещает железо и магний. Небольшая часть никеля присутствует в виде сульфидов. Никель проявляет сидерофильные и халькофильные свойства. При повышенном содержании в магме серы возникают сульфиды никеля вместе с медью, кобальтом, железом и платиноидами. В гидротермальном процессе совместно с кобальтом, мышьяком и серой и иногда с висмутом, ураном и серебром, никель образует повышенные концентрации в виде арсенидов и сульфидов никеля. Никель обычно содержится в сульфидных и мышьяк-содержащих медно-никелевых рудах.
* никелин (красный никелевый колчедан, купферникель) NiAs
* хлоантит (белый никелевый колчедан) (Ni, Co, Fe)As2
* гарниерит (Mg, Ni)6(Si4O11)(OH)6*H2O и другие силикаты
* магнитный колчедан (Fe, Ni, Cu)S
* мышьяково-никелевый блеск (герсдорфит) NiAsS,
* пентландит (Fe,Ni)9S8
В растениях в среднем 5×10−5 весовых процентов никеля, в морских животных — 1,6×10−4, в наземных — 1×10−6, в человеческом организме — 1…2×10−6. О никеле в организмах известно уже немало. Установлено, например, что содержание его в крови человека меняется с возрастом, что у животных количество никеля в организме повышено, наконец, что существуют некоторые растения и микроорганизмы — «концентраторы» никеля, содержащие в тысячи и даже в сотни тысяч раз больше никеля, чем окружающая среда.
Месторождения никелевых руд
Основные месторождения никелевых руд находятся в Канаде, России, Новой Каледонии, Филиппинах, Индонезии, Китае, Финляндии, Австралии. Природные изотопы никеля.
Природный никель содержит 5 стабильных изотопов: 58Ni (68.27 %), 60Ni (26.10 %), 61Ni (1.13 %), 62Ni (3.59 %), 64Ni (0.91 %).
Получение
Общие запасы никеля в рудах на начало 1998 г. оцениваются в количестве 135 млн т., в том числе достоверные — 49 млн.т.
Основные руды никеля — никелин (купферникель) NiAs, миллерит NiS, пентландит (FeNi)9S8 — содержат также мышьяк, железо и серу; в магматическом пирротине также встречаются включения пентландита. Другие руды, из которых тоже добывают Ni, содержат примеси Co, Cu, Fe и Mg. Иногда никель является основным продуктом процесса рафинирования, но чаще его получают как побочный продукт в технологиях других металлов. Из достоверных запасов, по разным данным, от 40 до 66 % никеля находится в «окисленных никелевых рудах» (ОНР), 33 % — в сульфидных, 0,7 % — в прочих. По состоянию на 1997 г. доля никеля, произведённого переработкой ОНР, составила порядка 40 % от общемирового объёма производства. В промышленных условиях ОНР делят на два типа: магнезиальные и железистые.
Тугоплавкие магнезиальные руды, как правило, подвергают электроплавке на ферроникель (5-50 % Ni+Co, в зависимости от состава сырья и технологических особенностей).
Наиболее железистые — латеритовые руды перерабатывают гидрометаллургическими методами с применением аммиачно-карбонатного выщелачивания или сернокислотного автоклавного выщелачивания. В зависимости от состава сырья и применяемых технологических схем конечными продуктами этих технологий являются: закись никеля (76-90 % Ni), синтер (89 % Ni), сульфидные концентраты различного состава, а также металлические никель электролитный, никелевые порошки и кобальт.
Менее железистые — нонтронитовые руды плавят на штейн. На предприятиях, работающих по полному циклу, дальнейшая схема переработки включает конвертирование, обжиг файнштейна, электроплавку закиси никеля с получением металлического никеля. Попутно извлекаемый кобальт выпускают в виде металла и/или солей. Ещё один источник никеля: в золе углей Южного Уэльса в Англии — до 78 кг никеля на тонну. Повышенное содержание никеля в некоторых каменных углях, пефтях, сланцах говорит о возможности концентрации никеля ископаемым органическим веществом. Причины этого явления пока не выяснены.
Основную массу никеля получают из гарниерита и магнитного колчедана.
1. Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5—8 % Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
2. Карбонильный способ (метод Монда). Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель , термическим разложением которого выделяют особо чистый металл.
3. Алюминотермический способ восстановления никеля из оксидной руды: 3NiO + 2Al = 3Ni +Al2O3
Применение
Сплавы
Никель является основой большинства суперсплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок.
* монель-металл (65 — 67 % Ni + 30 — 32 % Cu + 1 % Mn), жаростойкий до 500 °C, очень коррозионно-устойчив;
* белое золото (например 585 пробы содержит 58,5 % золота и сплав (лигатуру) из серебра и никеля (или палладия));
* нихром, сплав сопротивления (60 % Ni + 40 % Cr);
* пермаллой (76 % Ni + 17 %Fe + 5 % Cu + 2 % Cr), обладает высокой магнитной восприимчивостью при очень малых потерях на гистерезис;
* инвар (65 % Fe + 35 % Ni), почти не удлиняется при нагревании;
* Кроме того, к сплавам никеля относятся никелевые и хромоникелевые стали, нейзильбер и различные сплавы сопротивления типа константана, никелина и манганина.
Никелирование
Никелирование — создание никелевого покрытия на поверхности другого металла с целью предохранения его от коррозии. Проводится гальваническим способом с использованием электролитов, содержащих сульфат никеля(II), хлорид натрия, гидроксид бора, поверхностно-активные и глянцующие вещества, и растворимых никелевых анодов. Толщина получаемого никелевого слоя составляет 12 — 36 мкм. Устойчивость блеска поверхности может быть обеспечена последующим хромированием (толщина слоя хрома 0,3 мкм).
Бестоковое никелирование проводится в растворе смеси хлорида никеля(II) и гипофосфита натрия в присутствии цитрата натрия:
NiCl2 + NaH2PO2 + H2O = Ni + NaH2PO3 + 2HCl
Процесс проводят при рН 4 — 6 и 95 °C.
Производство аккумуляторов
Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов.
Радиационные технологии
Нуклид 63Ni, излучающий β+-частицы, имеет период полураспада 100,1 года и применяется в крайтронах.
Медицина
* Применяется при изготовлении брекет-систем (никелид титана).
* Протезирование
Монетное дело
Никель широко применяется при производстве монет во многих странах. В США монета достоинством в 5 центов носит разговорное название «никель».
Биологическая роль
Биологическая роль: никель относится к числу микроэлементов, необходимых для нормального развития живых организмов. Однако о его роли в живых организмах известно немного. Известно, что никель принимает участие в ферментативных реакциях у животных и растений. В организме животных он накапливается в ороговевших тканях, особенно в перьях. Повышенное содержание никеля в почвах приводят к эндемическим заболеваниям — у растений появляются уродливые формы, у животных — заболевания глаз, связанные с накоплением никеля в роговице. Токсическая доза (для крыс) — 50 мг. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил Ni(CO)4. ПДК соединений никеля в воздухе составляет от 0,0002 до 0,001 мг/м3 (для различных соединений).
Физиологическое действие
Никель — основная причина аллергии (контактного дерматита) на металлы, контактирующие с кожей (украшения, часы, джинсовые заклепки). В Евросоюзе ограничено содержание никеля в продукции, контактирующей с кожей человека.
Карбонил никеля — очень ядовит. Предельно допустимая концентрация его паров в воздухе производственных помещений 0.0005 мг/м³.
В XX веке было установлено, что поджелудочная железа очень богата никелем. При введении вслед за инсулином никеля продлевается действие инсулина и тем самым повышается гипогликемическая активность. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет переход сульфгидрильных групп в дисульфидные. Никель может угнетать действие адреналина и снижать артериальное давления. Избыточное поступление никеля в организм вызывает витилиго. Депонируется никель в поджелудочной и околощитовидной железах.
Никель - простое вещество, пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен. Относится к тяжелым цветным металлам, в чистом виде на земле не встречается — обычно входит в состав различных руд, высокой твердостью, хорошо полируется, является ферромагнетиком — притягивается магнитом, в периодической системе Менделеева обозначается символом Ni и имеет 28 порядковый номер.
Смотрите так же:
СТРУКТУРА
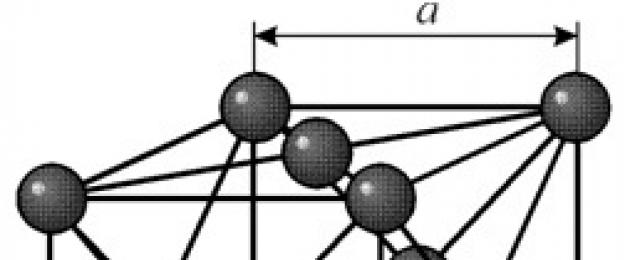
 Имеет гранецентрированную кубическую решетку с периодом a = 0,35238 å нм, пространственная группа Fm3m. Эта кристаллическая структура устойчива к давлению, по меньшей мере 70 ГПа. При обычных условиях никель существует в виде b-модификации, имеющей гранецентрированную кубическую решётку (a = 3,5236 å). Но никель, подвергнутый катодному распылению в атмосфере h 2 , образует a-модификацию, имеющую гексагональную решётку плотнейшей упаковки (а = 2,65 å, с = 4,32 å), которая при нагревании выше 200 °С переходит в кубическую. Компактный кубический никель имеет плотность 8,9 г/см 3 (20 °С), атомный радиус 1,24 å
Имеет гранецентрированную кубическую решетку с периодом a = 0,35238 å нм, пространственная группа Fm3m. Эта кристаллическая структура устойчива к давлению, по меньшей мере 70 ГПа. При обычных условиях никель существует в виде b-модификации, имеющей гранецентрированную кубическую решётку (a = 3,5236 å). Но никель, подвергнутый катодному распылению в атмосфере h 2 , образует a-модификацию, имеющую гексагональную решётку плотнейшей упаковки (а = 2,65 å, с = 4,32 å), которая при нагревании выше 200 °С переходит в кубическую. Компактный кубический никель имеет плотность 8,9 г/см 3 (20 °С), атомный радиус 1,24 å
СВОЙСТВА
 Никель - ковкий и тягучий металл, из него можно изготовлять тончайшие листы и трубки. Предел прочности при растяжении 400-500 Мн/м 2 , предел упругости 80 Мн/м 2 , предел текучести 120 Мн/м 2 ; относительное удлинение 40%; модуль нормальной упругости 205 Гн/м 2 ; твёрдость по Бринеллю 600-800 Мн/м 2 . В температурном интервале от 0 до 631К (верхняя граница соответствует Кюри точке). Ферромагнетизм никеля обусловлен особенностями строения внешних электронных оболочек его атомов. Никель входит в состав важнейших магнитных материалов и сплавов с минимальным значением коэффициента теплового расширения (пермаллой, монель-металл, инвар и др.).
Никель - ковкий и тягучий металл, из него можно изготовлять тончайшие листы и трубки. Предел прочности при растяжении 400-500 Мн/м 2 , предел упругости 80 Мн/м 2 , предел текучести 120 Мн/м 2 ; относительное удлинение 40%; модуль нормальной упругости 205 Гн/м 2 ; твёрдость по Бринеллю 600-800 Мн/м 2 . В температурном интервале от 0 до 631К (верхняя граница соответствует Кюри точке). Ферромагнетизм никеля обусловлен особенностями строения внешних электронных оболочек его атомов. Никель входит в состав важнейших магнитных материалов и сплавов с минимальным значением коэффициента теплового расширения (пермаллой, монель-металл, инвар и др.).
ЗАПАСЫ И ДОБЫЧА
 Никель довольно распространён в природе - его содержание в земной коре составляет около 0,01%(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8%). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13 - 0,41% Ni.
Никель довольно распространён в природе - его содержание в земной коре составляет около 0,01%(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8%). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13 - 0,41% Ni.
В растениях в среднем 5·10 −5 весовых процентов никеля, в морских животных - 1,6·10 −4 , в наземных - 1·10 −6 , в человеческом организме - 1…2·10 −6 .
Основную массу никеля получают из гарниерита и магнитного колчедана.
Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5-8% Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
Карбонильный способ (метод Монда): Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель , термическим разложением которого выделяют особо чистый металл.
Алюминотермический способ восстановления никеля из оксидной руды: 3NiO + 2Al = 3Ni +Al 2 O 3
ПРОИСХОЖДЕНИЕ
 Месторождения сульфидных медно-никелевых руд связаны с лополитоподобными или плитообразными массивами расслоенных габброидов, приуроченных к зонам глубинных разломов на древних щитах и платформах. Характерной особенностью медно-никелевых месторождений всего мира является выдержанный минеральный состав руд: пирротин, пентландит, халькопирит, магнетит; кроме них в рудах встречаются пирит, кубанит, полидимит, никелин, миллерит, виоларит, минералы группы платины, изредка хромит, арсениды никеля и кобальта, галенит, сфалерит, борнит, макинавит, валлерит, графит, самородное золото.
Месторождения сульфидных медно-никелевых руд связаны с лополитоподобными или плитообразными массивами расслоенных габброидов, приуроченных к зонам глубинных разломов на древних щитах и платформах. Характерной особенностью медно-никелевых месторождений всего мира является выдержанный минеральный состав руд: пирротин, пентландит, халькопирит, магнетит; кроме них в рудах встречаются пирит, кубанит, полидимит, никелин, миллерит, виоларит, минералы группы платины, изредка хромит, арсениды никеля и кобальта, галенит, сфалерит, борнит, макинавит, валлерит, графит, самородное золото.
Экзогенные месторождения силикатных никелевых руд повсеместно связаны с тем или иным типом коры выветривания серпентенитов. при выветривании происходит стадийное разложение минералов, а также перенос подвижных элементов, с помощью воды из верхних частей коры в нижние. Там эти элементы выпадают в осадок в виде вторичных минералов.
В месторождениях этого типа заключены запасы никеля в 3 раза превышающие его запасы в сульфидных рудах, а запасы некоторых месторождений достигают 1 млн т. и более никеля. Крупные запасы силикатных руд сосредоточены на Новой Каледонии, Филиппинах, Индонезии, Австралии и др. странах. Среднее содержание в них никеля равно 1.1-2%. Кроме того в рудах часто содержится кобальт.
ПРИМЕНЕНИЕ
Подавляющая часть никеля используется для получения сплавов с другими металлами (fe, cr, cu и др.), отличающихся высокими механическими, антикоррозионными, магнитными или электрическими и термоэлектрическими свойствами. В связи с развитием реактивной техники и созданием газотурбинных установок особенно важны жаропрочные и жаростойкие хромоникелевые сплавы. Сплавы никеля используются в конструкциях атомных реакторов.
Значительное количество никеля расходуется для производства щелочных аккумуляторов и антикоррозионных покрытий. Ковкий никель в чистом виде применяют для изготовления листов, труб и т.д. Он используется также в химической промышленности для изготовления специальной химической аппаратуры и как катализатор многих химических процессов. Никель - весьма дефицитный металл и по возможности должен заменяться другими, более дешёвыми и распространёнными материалами.
Применяется при изготовлении брекет-систем (никелид титана), протезирования. Широко применяется при производстве монет во многих странах. В США монета достоинством в 5 центов носит разговорное название «никель». Также никель используется для производства обмотки струн музыкальных инструментов.
Никель (англ. Nickel) — Ni
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/A.08-10 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.17.2 |
| Dana (8-ое издание) | 1.1.11.5 | Hey’s CIM Ref | 1.61 |
Свойства никеля являются важными параметрами для поиска, переработки и сфер применения металла. Они учитываются при формировании составов с другими материалами.
Свойства никеля определяют его использование в производстве
Никель — это металл со свойственным ему серебристо-белым цветом. При температуре 1453 °C переходит в жидкое состояние, а кипит при 2732 °C. Никель пластичен, легко поддается обработке под воздействием давления.
Химическое свойство никеля характеризуется способностью образовывать соединения с разной степенью окисления. В естественных условиях на поверхности металла возникает тонкая пленка из оксида.
Металл обладает высоким показателем устойчивости к коррозии. Никель не реагирует с рядом концентрированных кислот и щелочей, но активно растворяется в разбавленной азотной кислоте.

Вступая в химические реакции, никель образует летучие металлы и растворимые/нерастворимые соли
С никелем не вступают в реакцию:
- инертные газы;
- литий;
- калий;
- натрий;
- цезий;
- рубидий;
- стронций;
- барий;
- иридий;
- цезий.
С углеродным соединением никель образует карбонил - летучий переходный металл, используемый в процессе получения материалов высокого класса чистоты. Порошок никеля способен самовоспламеняться при соприкосновении с воздухом с образованием оксидов.
Никель продуцирует ряд растворимых и нерастворимых солей. Например, раствор сульфата металла придает жидкости зеленую окраску. Нерастворимые соли обычно имеют насыщенный желтый цвет.
Формы нахождения металла
В естественных условиях никель встречается в сочетании с рядом химических элементов, а в форме самородков находится в железных метеоритах.
В гидротермальных условиях никель формирует соединения с мышьяком, кобальтом, серебром. Повышенные концентрации металла связаны с минеральными образованиями-арсенидами и сульфидами.

В природе никель обычно находится в соединениях с другими элементами
Сырьем для извлечения ценного компонента являются сульфидные, медно-никелевые руды с содержанием мышьяка:
- никелин - соединение с мышьяком;
- хлоантит - белый колчедан, содержащий кобальт и железо;
- гарниерит - силикатная порода с содержанием магния;
- магнитный колчедан - соединение серы с железом и медью;
- герсдорфит - мышьяково-никелевый блеск;
- пентландит - соединение серы, железа и никеля.
Содержание металла в живых организмах зависит от условий и среды обитания. Некоторые представители флоры и фауны способны концентрировать металл.
Основные месторождения руд находятся в Канаде, Российской Федерации, Албании, ЮАР, на Кубе, в Греции.
Процесс извлечения металла из руд предусматривает применение технологий в зависимости от типа сырья. Иногда никель является второстепенным материалом обогащения породы.
Тугоплавкие руды с содержанием магния подвергают электрической выплавке. Содержащие железо латеритовые руды перерабатывают гидрометаллургическим методом с последующей обработкой щелочными растворами.
Породу с меньшим содержанием железа плавят, подвергают обжигу и электрической выплавке. Попутно извлекают металлический кобальт или его соли. Повышенное содержание металла наблюдается в золе каменных углей в Англии. Этот факт связывают с деятельностью микроорганизмов, концентрирующих никель.
Пластичность и другие физические свойства никелевых составов зависят от чистоты материала. Незначительная примесь серы придает металлу хрупкость. Добавление в расплавленный материал магния очищает смесь от второстепенных примесей с образованием соединения с серой.
Отрасли применения никеля
Физико-химические свойства металла определяют его использование:
- в изготовлении нержавеющей стали;
- для формирования сплавов, не содержащих железо;
- с целью нанесения защитных покрытий на изделия гальваническим способом;
- для производства химических реактивов;
- в порошковой металлургии.
Металл применяют при производстве аккумуляторов, с его помощью происходят каталитические процессы химических реакций в промышленном производстве. Сплавы с титаном являются отличным материалом для изготовления протезов и приспособлений для выравнивания зубов.
Состав на основе химического элемента № 28 является сырьем для чеканки монет, изготовления спиралей электронных сигарет. Его используют для обмотки струн музыкальных инструментов.
При изготовлении сердечников для электромагнитов используются составы - пермаллои, включающие 20–60% железа. Никель используется при изготовлении различных деталей и аппаратуры для химической отрасли промышленности.
Оксиды металла применяются при производстве стекла, глазури и керамических изделий. Современное производство специализируется на изготовлении разнообразного проката: проволоки, ленты, фольги, трубок.

Никель имеет широкую сферу применения от покрытий до химических реактивов
Устойчивость к агрессивной среде позволяют использовать прокат из никеля для транспортировки щелочей в химической отрасли.
Инструменты из сплава на основе никеля применяются в медицине и при проведении научных исследований. Металл используется при создании точных приборов для дистанционного управления процессами в атомной энергетике, радиолокационных установок.
Характеристика никелевых сплавов
В составах металл сочетается в основном с железом и кобальтом. Его применяют в качестве лигатурного компонента для производства различных конструкционных видов стали, магнитных и немагнитных сплавов.
Металлические сплавы на основе химического элемента № 28 обладают прочностью, устойчивостью к температурам, деформации, влиянию внешней среды. Их число достигает нескольких тысяч. Самыми распространенными составами являются сочетания с хромом, молибденом, алюминием, титаном, бериллием.
Металл считается лигатурным компонентом золота, придающим ювелирным изделиям характерный белый цвет и прочность. По отношению к этому составу существуют мнения об аллергическом влиянии никеля на кожу.
В сочетании с хромом образуется соединение нихром, обладающее устойчивостью к высокой температуре, минимальным коэффициентом электрического сопротивления, пластичностью.
Его применяют для изготовления нагревательных приборов, деталей, в качестве покрытия. Высокая прочность соединения позволяет подвергать его механической обработке, точению, сварке, штамповке.

Никелевые сплавы обладают высокой прочностью, что позволяет широко использовать их в производстве
Особую группу образуют сплавы, в состав которых включена медь. Среди них самыми популярными являются:
- монель;
- латунь;
- бронза;
- нейзильбер.
Более века назад было установлено, что железно-никелевый состав, содержащий 28% описываемого металла, теряет свои свойства к намагничиванию. Сплавам, содержащим 36% никеля, свойственен незначительный показатель линейного расширения, что позволяет его применять в изготовлении точных приборов и инструментов.
Этот состав, который обозначается FeNi36, называется инваром, то есть «неизменным». Широкое применение в производстве нашел сплав ковар, содержащий 29%никеля, 17% кобальта и 54% железа.
Он обладает высокой адгезией к расплавленному стеклу, что позволяет использовать состав для изготовления электрических выводов, проходящих через данное вещество.