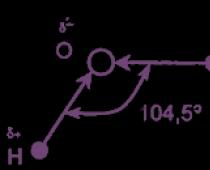
Вода (оксид водорода) - бинарное неорганическое соединение с химической формулой Н 2 O. Молекула воды состоит из двух атомов водорода и одного - кислорода, которые соединены между собой ковалентной связью.
Пероксид водорода.
Физические и химические свойства
Физические и химические свойства воды определяются химическим, электронным и пространственным строением молекул Н 2 O.
Атомы Н и О в молекуле Н 2 0 находятся в своих устойчивых степенях окисления, соответственно +1 и -2; поэтому вода не проявляет ярко выраженных окислительных или восстановительных свойств. Обратите внимание: в гидридах металлов водород находится в степени окисления -1.

Молекула Н 2 O имеет угловое строение. Связи Н-O очень полярны. На атоме О существует избыточный отрицательный заряд, на атомах Н - избыточные положительные заряды. 8 целом молекула Н 2 O является полярной, т.е. диполем. Этим объясняется тот факт, что вода является хорошим растворителем для ионных и полярных веществ.

Наличие избыточных зарядов на атомах Н и О, а также неподеленных электронных пар у атомов О обусловливает образование между молекулами воды водородных связей, вследствие чего они объединяются в ассоциаты. Существованием этих ассоциатов объясняются аномально высокие значения т. пл. и т. кип. воды.
Наряду с образованием водородных связей, результатом взаимного влияния молекул Н 2 O друг на друга является их самоионизация:
в одной молекуле происходит гетеролитический разрыв полярной связи О-Н, и освободившийся протон присоединяется к атому кислорода другой молекулы. Образующийся ион гидроксония Н 3 О + по существу является гидратированным ионом водорода Н + Н 2 O, поэтому упрощенно уравнение самоионизации воды записывается так:
Н 2 O ↔ H + + OH -
Константа диссоциации воды чрезвычайно мала:
Это свидетельствует о том, что вода очень незначительно диссоциирует на ионы, и поэтому концентрация недиссоциированных молекул Н 2 O практически постоянна:

В чистой воде [Н + ] = [ОН - ] = 10 -7 моль/л. Это означает, что вода представляет собой очень слабый амфотерный электролит, не проявляющий в заметной степени ни кислотных, ни основных свойств.
Однако вода оказывает сильное ионизирующее действие на растворенные в ней электролиты. Под действием диполей воды полярные ковалентные связи в молекулах растворенных веществ превращаются в ионные, ионы гидратируются, связи между ними ослабляются, в результате чего происходит электролитическая диссоциация. Например:
HCl + Н 2 O - Н 3 O + + Сl -
(сильный электролит)
(или без учета гидратации: HCl → Н + + Сl -)
CH 3 COOH + H 2 O ↔ CH 3 COO - + H + (слабый электролит)
(или CH 3 COOH ↔ CH 3 COO - + H +)
Согласно теории кислот и оснований Брёнстеда-Лоури, в этих процессах вода проявляет свойства основания (акцептор протонов). По той же теории в роли кислоты (донора протонов) вода выступает в реакциях, например, с аммиаком и аминами:
NH 3 + H 2 O ↔ NH 4 + + OH -
CH 3 NH 2 + H 2 O ↔ CH 3 NH 3 + + OH -
Окислительно-восстановительные реакции с участием воды
I. Реакции, в которых вода играет роль окислителя
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н 2 О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н + 2 О = 2NaOH + H 0 2
Ca + 2Н + 2 О = Ca(OH) 2 + H 0 2
б) При высокой температуре Н 2 О вступает в реакции и с некоторыми другими металлами, например:
Mg + 2Н + 2 О = Mg(OH) 2 + H 0 2
3Fe + 4Н + 2 О = Fe 2 O 4 + 4H 0 2
в) Al и Zn вытесняют Н 2 из воды в присутствии щелочей:
2Al + 6Н + 2 О + 2NaOH = 2Na + 3H 0 2
2) Взаимодействие с неметаллами, имеющими низкую ЭО (реакции происходят в жестких условиях)
C + Н + 2 О = CO + H 0 2 («водяной газ»)
2P + 6Н + 2 О = 2HPO 3 + 5H 0 2
В присутствии щелочей кремний вытесняет водород из воды:
Si + Н + 2 О + 2NaOH = Na 2 SiO 3 + 2H 0 2
3) Взаимодействие с гидридами металлов
NaH + Н + 2 O = NaOH + H 0 2
CaH 2 + 2Н + 2 О = Ca(OH) 2 + 2H 0 2
4) Взаимодействие с угарным газом и метаном
CO + Н + 2 O = CO 2 + H 0 2
2CH 4 + O 2 + 2Н + 2 O = 2CO 2 + 6H 0 2
Реакции используются в промышленности для получения водорода.
II. Реакции, в которых вода играет роль восстановителя
ти реакции возможны только с очень сильными окислителями, которые способны окислить кислород СО С. О. -2, входящий в состав воды, до свободного кислорода O 2 или до пероксид-анионов 2- . В исключительном случае (в реакции с F 2) образуется кислород со c o. +2.
1) Взаимодействие с фтором
2F 2 + 2Н 2 O -2 = O 0 2 + 4HF
2F 2 + Н 2 O -2 = O +2 F 2 + 2HF
2) Взаимодействие с атомарным кислородом
Н 2 O -2 + O = Н 2 O - 2
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
2Cl 2 + 2Н 2 O -2 = O 0 2 + 4HCl
III. Реакции внутримолекулярного окисления - восстановления воды.
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
2Н + 2 O -2 = 2H 0 2 + O 0 2
Термическое разложение - процесс обратимый; степень термического разложения воды невелика.
Реакции гидратации
I. Гидратация ионов. Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 5H 2 O, FeSO 4 7Н 2 O и др., а также аквакомплексов: CI 3 , Br 4 и др.
II. Гидратация оксидов

III. Гидратация органических соединений, содержащих кратные связи

Реакции гидролиза
I. Гидролиз солей
Обратимый гидролиз:
а) по катиону соли
Fe 3+ + Н 2 O = FeOH 2+ + Н + ; (кислая среда. рН
б) по аниону соли
СО 3 2- + Н 2 O = НСО 3 - + ОН - ; (щелочная среда. рН > 7)
в) по катиону и по аниону соли
NH 4 + + СН 3 СОО - + Н 2 O = NH 4 OH + СН 3 СООН (среда, близкая к нейтральной)
Необратимый гидролиз:
Al 2 S 3 + 6Н 2 O = 2Аl(ОН) 3 ↓ + 3H 2 S
II. Гидролиз карбидов металлов
Al 4 C 3 + 12Н 2 O = 4Аl(ОН) 3 ↓ + 3CH 4 нетан
СаС 2 + 2Н 2 O = Са(ОН) 2 + С 2 Н 2 ацетилен
III. Гидролиз силицидов, нитридов, фосфидов
Mg 2 Si + 4Н 2 O = 2Mg(OH) 2 ↓ + SiH 4 силан
Ca 3 N 2 + 6Н 2 O = ЗСа(ОН) 2 + 2NH 3 аммиак
Cu 3 P 2 + 6Н 2 O = ЗСu(ОН) 2 + 2РН 3 фосфин
IV. Гидролиз галогенов
Cl 2 + Н 2 O = HCl + HClO
Вr 2 + Н 2 O = НВr + НВrО
V. Гидролиз органических соединений
Классы органических веществ |
Продукты гидролиза (органические) |
Галогеналканы (алкилгалогениды) |
|
Арилгалогениды |
|
Дигалогеналканы |
Альдегиды или кетоны |
Алкоголяты металлов |
|
Галогенангидриды карбоновых кислот |
Карбоновые кислоты |
Ангидриды карбоновых кислот |
Карбоновые кислоты |
Сложные зфиры карбоновых кислот |
Карбоновые кислоты и спирты |
Глицерин и высшие карбоновые кислоты |
|
Ди- и полисахариды |
Моносахариды |
Пептиды и белки |
α-Аминокислоты |
Нуклеиновые кислоты |
|
Многие исследователи 19 в., получавшие чистый пероксид водорода, отмечали опасность этого соединения. Так, когда пытались отделить Н
2 О 2 от воды путем экстракции из разбавленных растворов диэтиловым эфиром с последующей отгонкой летучего эфира, полученное вещество иногда без видимых причин взрывалось. В одном из таких опытов немецкий химик Ю.В.Брюль получил безводный Н 2 О 2 , который обладал запахом озона и взорвался от прикосновения неоплавленной стеклянной палочки. Несмотря на малые количества Н 2 О 2 (всего 12 мл) взрыв был такой силы, что пробил круглую дыру в доске стола, разрушил содержимое его ящика, а также стоящие на столе и поблизости склянки и приборы. Физические свойства. Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н 2 О 2 , который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см 3 ). Замерзает Н 2 О 2 при температурой немного меньшей, чем температура замерзания воды при минус 0,41° С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н 2 О 2 замерзают при значительно более низкой температуре: 30%-ный раствор при минус 30° С, а 60%-ный при минус 53° С. Кипит Н 2 О 2 при температуре более высокой, чем обычная вода, при 150,2° С. Смачивает стекло Н 2 О 2 хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н 2 О 2 , жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.В статье, посвященной получению пероксида водорода, Тенар не очень удачно сравнил это вещество с сиропом, возможно, он имел в виду, что чистый Н
2 О 2 , как и сахарный сироп, сильно преломляет свет. Действительно, коэффициент преломления безводного Н 2 О 2 (1,41) намного больше, чем у воды (1,33). Однако то ли в результате неверного толкования, то ли из-за плохого перевода с французского, практически во всех учебниках до сих пор пишут, что чистый пероксид водорода «густая сиропообразная жидкость», и даже объясняют это теоретически образованием водородных связей. Но ведь вода тоже образует водородные связи. На самом деле вязкость у Н 2 О 2 такая же, как и у чуть охлажденной (примерно до 13° С) воды, но нельзя сказать, что прохладная вода густая, как сироп. Реакция разложения. Чистый пероксид водорода вещество очень опасное, так как при некоторых условиях возможно его взрывное разложение: Н 2 О 2 ® Н 2 О + 1/2 О 2 с выделением 98 кДж на моль Н 2 О 2 (34 г). Это очень большая энергия: она больше, чем та, которая выделяется при образовании 1 моля HCl при взрыве смеси водорода и хлора; ее достаточно, чтобы полностью испарить в 2,5 раза больше воды, чем образуется в этой реакции. Опасны и концентрированные водные растворы Н 2 О 2 , в их присутствии легко самовоспламеняются многие органические соединения, а при ударе такие смеси могут взрываться. Для хранения концентрированных растворов используют сосуды из особо чистого алюминия или парафинированные стеклянные сосуды.Чаще приходится встречаться с менее концентрированным 30%-ным раствором Н
2 О 2 , который называется пергидролем, но и такой раствор опасен: вызывает ожоги на коже (при его действии кожа сразу же белеет из-за обесцвечивания красящих веществ), при попадании примесей возможно взрывное вскипание. Разложение Н 2 О 2 и его растворов, в том числе и взрывное, вызывают многие вещества, например, ионы тяжелых металлов, которые при этом играют роль катализатора, и даже пылинки. 2 О 2 объясняются сильной экзотермичностью реакции, цепным характером процесса и значительным снижением энергии активации разложения Н 2 О 2 в присутствии различных веществ, о чем можно судить по следующим данным: Фермент каталаза содержится в крови; именно благодаря ей «вскипает» от выделения кислорода аптечная «перекись водорода», когда ее используют для дезинфекции порезанного пальца. Реакцию разложения концентрированного раствора Н 2 О 2 под действием каталазы использует не только человек; именно эта реакция помогает жуку-бомбардиру бороться с врагами, выпуская в них горячую струю (см . ВЗРЫВЧАТЫЕ ВЕЩЕСТВА ). Другой фермент пероксидаза действует иначе: он не разлагает Н 2 О 2 , но в его присутствии происходит окисление других веществ пероксидом водорода.Ферменты, влияющие на реакции пероксида водорода, играют большую роль в жизнедеятельности клетки. Энергию организму поставляют реакции окисления с участием поступающего из легких кислорода. В этих реакциях промежуточно образуется Н
2 О 2 , который вреден для клетки, так как вызывает необратимое повреждение различных биомолекул. Каталаза и пероксидаза совместно превращают Н 2 О 2 в воду и кислород.Реакция разложения Н
2 О 2 часто протекает по радикально-цепному механизму (см . ЦЕПНЫЕ РЕАКЦИИ ), при этом роль катализатора заключается в инициировании свободных радикалов. Так, в смеси водных растворов Н 2 О 2 и Fe 2+ (так называемый реактив Фентона) идет реакция переноса электрона с иона Fe 2+ на молекулу H 2 O 2 с образованием иона Fe 3+ и очень неустойчивого анион-радикала . , который сразу же распадается на анион ОН и свободный гидроксильный радикал ОН . ( см . СВОБОДНЫЕ РАДИКАЛЫ ). Радикал ОН . очень активен. Если в системе есть органические соединения, то возможны их разнообразные реакции с гидроксильными радикалами. Так, ароматические соединения и оксикислоты окисляются (бензол, например, превращается в фенол), непредельные соединения могут присоединить гидроксильные группы по двойной связи: СН 2 =СНСН 2 ОН + 2ОН . ® НОСН 2 СН(ОН)СН 2 ОН, а могут вступить в реакцию полимеризации. В отсутствие же подходящих реагентов ОН . реагирует с Н 2 О 2 с образованием менее активного радикала НО 2 . , который способен восстанавливать ионы Fe 2+ , что замыкает каталитический цикл: H 2 O 2 + Fe 2+ ® Fe 3+ + OH . + OH ОН . + Н 2 О 2 ® H 2 O + HO 2 .HO 2 . + Fe 3+
® Fe 2+ + O 2 + H + ® H 2 O. При определенных условиях возможно цепное разложение Н 2 О 2 , упрощенный механизм которого можно представить схемой . + Н 2 О 2 ® H 2 O + HO 2 . 2 . + H 2 O 2 ® H 2 O + O 2 + OH . и т.д.Реакции разложения Н
2 О 2 идут в присутствии различных металлов переменной валентности. Связанные в комплексные соединения, они часто значительно усиливают свою активность. Например, ионы меди менее активны, чем ионы железа, но связанные в аммиачные комплексы 2+ , они вызывают быстрое разложение Н 2 О 2 . Аналогичное действие оказывают ионы Mn 2+ связанные в комплексы с некоторыми органическими соединениями. В присутствии этих ионов удалось измерить длину цепи реакции. Для этого сначала измерили скорость реакции по скорости выделения из раствора кислорода. Затем в раствор ввели в очень малой концентрации (около 10 5 моль/л) ингибитор вещество, эффективно реагирующее со свободными радикалами и обрывающее таким образом цепь. Выделение кислорода сразу же прекратилось, но примерно через 10 минут, когда весь ингибитор израсходовался, снова возобновилось с прежней скоростью. Зная скорость реакции и скорость обрыва цепей, нетрудно рассчитать длину цепи, которая оказалась равной 10 3 звеньев. Большая длина цепи обусловливает высокую эффективность разложения Н 2 О 2 в присутствии наиболее эффективных катализаторов, которые с высокой скоростью генерируют свободные радикалы. При указанной длине цепи скорость разложения Н 2 О 2 фактически увеличивается в тысячу раз.Иногда заметное разложение Н
2 О 2 вызывают даже следы примесей, которые почти не обнаруживаются аналитически. Так, одним из самых эффективных катализаторов оказался золь металлического осмия: сильное каталитическое действие его наблюдалось даже при разведении 1:10 9 , т.е. 1 г Os на 1000 т воды. Активными катализаторами являются коллоидные растворы палладия, платины, иридия, золота, серебра, а также твердые оксиды некоторых металлов MnO 2 , Co 2 O 3 , PbO 2 и др., которые сами при этом не изменяются. Разложение может идти очень бурно. Так, если маленькую щепотку MnO 2 бросить в пробирку с 30%-ным раствором Н 2 О 2 , из пробирки вырывается столб пара с брызгами жидкости. С более концентрированными растворами происходит взрыв. Более спокойно протекает разложение на поверхности платины. При этом на скорость реакции сильное влияние оказывает состояние поверхности. Немецкий химик Вальтер Шпринг провел в конце 19 в. такой опыт. В тщательно очищенной и отполированной платиновой чашке реакция разложения 38%-ного раствора Н 2 О 2 не шла даже при нагревании до 60° С. Если же сделать иглой на дне чашки еле заметную царапину, то уже холодный (при 12° С) раствор начинает выделять на месте царапины пузырьки кислорода, а при нагревании разложение вдоль этого места заметно усиливается. Если же в такой раствор ввести губчатую платину, обладающую очень большой поверхностью, то возможно взрывное разложение.Быстрое разложение Н
2 О 2 можно использовать для эффектного лекционного опыта, если до внесения катализатора добавить к раствору поверхностно-активное вещество (мыло, шампунь). Выделяющийся кислород создает обильную белую пену, которую назвали «зубной пастой для слона».Некоторые катализаторы инициируют нецепное разложение Н
2 О 2 , например: H 2 O 2 + 2I + 2H + ® 2H 2 O + I 2 ® 2I + 2H + + O 2 . Нецепная реакция идет и в случае окисления ионов Fe 2+ в кислых растворах: 2FeSO 4 + H 2 O 2 + H 2 SO 4 ® Fe 2 (SO 4) 3 + 2H 2 O. Поскольку в водных растворах почти всегда есть следы различных катализаторов (катализировать разложение могут и ионы металлов, содержащихся в стекле), к растворам Н 2 О 2 , даже разбавленным, при их длительном хранении добавляют ингибиторы и стабилизаторы, связывающие ионы металлов. При этом растворы слегка подкисляют, так как при действии чистой воды на стекло получается слабощелочной раствор, что способствует разложению Н 2 О 2 . Все эти особенности разложения Н 2 О 2 позволяют разрешить противоречие. Для получения чистого Н 2 О 2 необходимо проводить перегонку при пониженном давлении, поскольку вещество разлагается при нагревании выше 70° С и даже, хотя очень медленно, при комнатной температуре (как сказано в Химической энциклопедии, со скоростью 0,5% в год). В таком случае, как же получена фигурирующая в той же энциклопедии температура кипения при атмосферном давлении, равная 150,2° С? Обычно в таких случаях используют физико-химическую закономерность: логарифм давления пара жидкости линейно зависит от обратной температуры (по шкале Кельвина), поэтому если точно измерить давление пара Н 2 О 2 при нескольких (невысоких) температурах, то легко можно рассчитать, при какой температуре это давление достигнет 760 мм рт.ст. А это и есть температура кипения при обычных условиях.Теоретически радикалы ОН
. могут образоваться и в отсутствие инициаторов, в результате разрыва более слабой связи ОО, но для этого нужна довольно высокая температура. Несмотря на относительно небольшую энергию разрыва этой связи в молекуле Н 2 О 2 (она равна 214 кДж/моль, что в 2,3 раза меньше, чем для связи НОН в молекуле воды), связь ОО все же достаточно прочная, чтобы пероксид водорода был абсолютно устойчив при комнатной температуре. И даже при температуре кипения (150° С) он должен разлагаться очень медленно. Расчет показывает, что при этой температуре разложение на 0,5% должно происходить тоже достаточно медленно, даже если длина цепи равна 1000 звеньев. Несоответствие расчетов и опытных данных объясняется каталитическим разложением, вызванным и мельчайшими примесями в жидкости и стенками реакционного сосуда. Поэтому измеренная многими авторами энергия активации разложения Н 2 О 2 всегда значительно меньше, чем 214 кДж/моль даже «в отсутствие катализатора». На самом деле катализатор разложения всегда есть и в виде ничтожных примесей в растворе, и в виде стенок сосуда, именно поэтому нагревание безводного Н 2 О 2 до кипения при атмосферном давлении неоднократно вызывало взрывы.В некоторых условиях разложение Н
2 О 2 происходит очень необычно, например, если нагреть подкисленный серной кислотой раствор Н 2 О 2 в присутствии иодата калия KIO 3 , то при определенных концентрациях реагентов наблюдается колебательная реакция, при этом выделение кислорода периодически прекращается, а потом возобновляется с периодом от 40 до 800 секунд. Химические свойства Н 2 О 2 . Пероксид водорода кислота, но очень слабая. Константа диссоциации H 2 O 2 H + + HO 2 при 25° С равна 2,4·10 12 , что на 5 порядков меньше, чем для H 2 S. Средние соли Н 2 О 2 щелочных и щелочноземельных металлов обычно называют пероксидами (см . ПЕРОКСИДЫ ). При растворении в воде они почти полностью гидролизуются: Na 2 O 2 + 2H 2 O ® 2NaOH + H 2 O 2 . Гидролизу способствует подкисление растворов. Как кислота Н 2 О 2 образует и кислые соли, например, Ва(НО 2) 2 , NaHO 2 и др. Кислые соли менее подвержены гидролизу, но легко разлагаются при нагревании с выделением кислорода: 2NaHO 2 ® 2NaOH + O 2 . Выделяющаяся щелочь, как и в случае Н 2 О 2 , способствует разложению.Растворы Н
2 О 2 , особенно концентрированные, обладают сильным окислительным действием. Так, при действии 65%-ного раствора Н 2 О 2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Необычно идет окисление формальдегида: Н 2 О 2 восстанавливается не до воды (как обычно), а до свободного водорода: 2НСНО + Н 2 О 2 ® 2НСООН + Н 2 . Если взять 30%-ный раствор Н 2 О 2 и 40%-ный раствор НСНО, то после небольшого подогрева начинается бурная реакция, жидкость вскипает и пенится. Окислительное действие разбавленных растворов Н 2 О 2 больше всего проявляется в кислой среде, например, H 2 O 2 + H 2 C 2 O 4 ® 2H 2 O + 2CO 2 , но возможно окисление и в щелочной среде: Na + H 2 O 2 + NaOH ® Na 2 ; 2K 3 + 3H 2 O 2 ® 2KCrO 4 + 2KOH + 8H 2 O. Окисление черного сульфида свинца до белого сульфата PbS + 4H 2 O 2 ® PbSO 4 + 4H 2 O можно использовать для восстановления потемневших свинцовых белил на старых картинах. Под действием света идет окисление и соляной кислоты: H 2 O 2 + 2HCl ® 2H 2 O + Cl 2 . Добавление Н 2 О 2 к кислотам сильно увеличивает их действие на металлы. Так, в смеси H 2 O 2 и разбавленной H 2 SO 4 растворяются медь, серебро и ртуть; иод в кислой среде окисляется до иодной кислоты HIO 3 , сернистый газ до серной кислоты и т.д.Необычно происходит окисление калий-натриевой соли винной кислоты (сегнетовой соли) в присутствии хлорида кобальта в качестве катализатора. В ходе реакции KOOC(CHOH)
2 COONa + 5H 2 O 2 ® KHCO 3 + NaHCO 3 + 6H 2 O + 2CO 2 розовый CoCl 2 изменяет цвет на зеленый из-за образования комплексного соединения с тартратом анионом винной кислоты. По мере протекания реакции и окисления тартрата комплекс разрушается и катализатор снова розовеет. Если вместо хлорида кобальта использовать в качестве катализатора медный купорос, то промежуточное соединение, в зависимости от соотношения исходных реагентов, будет окрашено в оранжевый или зеленый цвет. После окончания реакции восстанавливается синий цвет медного купороса.Совершенно иначе реагирует пероксид водорода в присутствии сильных окислителей, а также веществ, легко отдающих кислород. В таких случаях Н
2 О 2 может выступать и как восстановитель с одновременным выделением кислорода (так называемый восстановительный распад Н 2 О 2 ), например: 2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 ® K 2 SO 4 + 2MnSO 4 + 5O 2 + 8H 2 O;Ag 2 O + H 2 O 2
® 2Ag + H 2 O + O 2 ; О 3 + Н 2 О 2 ® H 2 O + 2O 2 ; ® NaCl + H 2 O + O 2 . Последняя реакция интересна тем, что в ней образуются возбужденные молекулы кислорода, которые испускают оранжевую флуоресценцию (см . ХЛОР АКТИВНЫЙ ). Аналогично из растворов солей золота выделяется металлическое золото, из оксида ртути получается металлическая ртуть и т.д. Такое необычное свойство Н 2 О 2 позволяет, например, провести окисление гексацианоферрата(II) калия, а затем, изменив условия, восстановить продукт реакции в исходное соединение с помощью того же реактива. Первая реакция идет в кислой среде, вторая в щелочной: 2K 4 + H 2 O 2 + H 2 SO 4 ® 2K 3 + K 2 SO 4 + 2H 2 O;2K 3 + H 2 O 2 + 2KOH
® 2K 4 + 2H 2 O + O 2 . («Двойственный характер» Н 2 О 2 позволил одному преподавателю химии сравнить пероксид водорода с героем повести известного английского писателя Стивенсона Странная история доктора Джекила и мистера Хайда , под влиянием придуманного им состава он мог резко изменять свой характер, превращаясь из добропорядочного джентльмена в кровожадного маньяка.) Получение Н 2 О 2 . Молекулы Н 2 О 2 всегда получаются в небольших количествах при горении и окислении различных соединений. При горении Н 2 О 2 образуется либо при отрыве атомов водорода от исходных соединений промежуточными гидропероксидными радикалами, например: HO 2 . + CH 4 ® H 2 O 2 + CH 3 . , либо в результате рекомбинации активных свободных радикалов: 2ОН . ® Н 2 О 2 , Н . + НО 2 . ® Н 2 О 2 . Например, если кислородно-водородное пламя направить на кусок льда, то растаявшая вода будет содержать в заметных количествах Н 2 О 2 , образовавшийся в результате рекомбинации свободных радикалов (в пламени молекулы Н 2 О 2 немедленно распадаются). Аналогичный результат получается и при горении других газов. Образование Н 2 О 2 может происходить и при невысокой температуре в результате различных окислительно-восстановительных процессов.В промышленности пероксид водорода уже давно не получают способом Тенара из пероксида бария, а используют более современные методы. Один из них электролиз растворов серной кислоты. При этом на аноде сульфат-ионы окисляются до надсульфат-ионов: 2SO
4 2 2e ® S 2 O 8 2 . Надсерная кислота затем гидролизуется: H 2 S 2 O 8 + 2H 2 O ® H 2 O 2 + 2H 2 SO 4 . На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением 2H 2 O ® H 2 O 2 + H 2 . Но основной современный способ (свыше 80% мирового производства) окисление некоторых органических соединений, например, этилантрагидрохинона, кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н 2 О 2 и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида): (СН 3) 2 СНОН + О 2 ® (СН 3) 2 С(ООН)ОН ® (СН 3) 2 СО + Н 2 О 2 . При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта. Применение Н 2 О 2 . Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н 2 О 2 применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н 2 О 2 , но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н 2 О 2 на чистую воду и кислород.Когда-то модно было обесцвечивать волосы «перекисью», сейчас для окраски волос существуют более безопасные составы.
В присутствии некоторых солей пероксид водорода образует как бы твердый «концентрат», который удобнее перевозить и использовать. Так, если к сильно охлажденному насыщенному раствору борнокислого натрия (буры ) добавить Н
2 О 2 в присутствии, постепенно образуются большие прозрачные кристаллы пероксобората натрия Na 2 [(BO 2) 2 (OH) 4 ]. Это вещество широко используется для отбеливания тканей и как компонент моющих средств. Молекулы Н 2 О 2 , как и молекулы воды, способны внедряться в кристаллическую структуру солей, образуя подобие кристаллогидратов пероксогидраты, например, К 2 СО 3 ·3Н 2 О 2 , Na 2 CO 3 ·1,5H 2 O; последнее соединение широко известное под названием «персоль».Так называемый «гидроперит» CO(NH
2) 2 ·H 2 O 2 представляет собой клатрат соединение включения молекул Н 2 О 2 в пустоты кристаллической решетки мочевины.В аналитической химии с помощью пероксида водорода можно определять некоторые металлы. Например, если к раствору соли титана(IV) сульфата титанила добавить пероксид водорода, раствор приобретает ярко-оранжевый цвет вследствие образования надтитановой кислоты:
TiOSO 4 + H 2 SO 4 + H 2 O 2 ® H 2 + H 2 O. Бесцветный молибдат-ион MoO 4 2 окисляется Н 2 О 2 в интенсивно окрашенный в оранжевый цвет пероксидный анион. Подкисленный раствор дихромата калия в присутствии Н 2 О 2 образует надхромовую кислоту: K 2 Cr 2 O 7 + H 2 SO 4 + 5H 2 O 2 ® H 2 Cr 2 O 12 + K 2 SO 4 + 5H 2 O, которая довольно быстро разлагается: H 2 Cr 2 O 12 + 3H 2 SO 4 ® Cr 2 (SO 4) 3 + 4H 2 O + 4O 2 . Если сложить эти два уравнения, получится реакция восстановления пероксидом водорода дихромата калия: K 2 Cr 2 O 7 + 4H 2 SO 4 + 5H 2 O 2 ® Cr 2 (SO 4) 3 + K 2 SO 4 + 9H 2 O + 4O 2 . Надхромовую кислоту можно извлечь из водного раствора эфиром (в растворе эфира она значительно более устойчива, чем в воде). Эфирный слой при этом окрашивается в интенсивный синий цвет.Илья Леенсон
ЛИТЕРАТУРА Долгоплоск Б.А., Тинякова Е.И. Генерирование свободных радикалов и их реакции . М., Химия, 1982Химия и технология перекиси водорода . Л., Химия, 1984
§3. Уравнение реакции и как его составить
Взаимодействие водорода
с кислородом
, как это установил еще сэр Генри Кавендиш , приводит к образованию воды.
Давайте на этом простом примере поучимся составлять уравнения химических реакций
.
Что получается из водорода
и кислорода
, мы уже знаем:
Н 2 + О 2 → Н 2 О
Теперь учтем, что атомы химических элементов в химических реакциях не исчезают и не появляются из ничего, не превращаются друг в друга, а соединяются в новых комбинациях , образуя новые молекулы. Значит, в уравнении химической реакции атомов каждого сорта должно быть одинаковое количество до реакции (слева от знака равенства) и после окончания реакции (справа от знака равенства), вот так:
2Н 2 + О 2 = 2Н 2 О
Это и есть уравнение реакции - условная запись протекающей химической реакции с помощью формул веществ и коэффициентов .
Это значит, что в приведенной реакции два моля водорода должны прореагировать с одним молем кислорода , и в результате получится два моля воды .
Взаимодействие водорода с кислородом - совсем не простой процесс. Он приводит к изменению степеней окисления этих элементов. Чтобы подбирать коэффициенты в таких уравнениях, обычно пользуются методом "электронного баланса ".
Когда из водорода и кислорода образуется вода, то это значит, что водород поменял свою степень окисления от 0 до +I , а кислород - от 0 до −II . При этом от атомов водорода к атомам кислорода перешло несколько (n) электронов:
Водород, отдающий электроны, служит здесь восстановителем , а кислород, принимающий электроны - окислителем .
Окислители и восстановители
Посмотрим теперь, как выглядят процессы отдачи и приема электронов по отдельности. Водород , встретившись с "грабителем"-кислородом, теряет все свое достояние - два электрона, и его степень окисления становится равной +I :
Н 2 0 − 2e − = 2Н +I
Получилось уравнение полуреакции окисления водорода.
А бандит-кислород О 2 , отняв последние электроны у несчастного водорода, очень доволен своей новой степенью окисления -II :
O 2 + 4e − = 2O −II
Это уравнение полуреакции восстановления кислорода.
Остается добавить, что и "бандит", и его "жертва" потеряли свою химическую индивидуальность и из простых веществ - газов с двухатомными молекулами Н 2 и О 2 превратились в составные части нового химического вещества - воды Н 2 О .
Дальше будем рассуждать следующим образом: сколько электронов отдал восстановитель бандиту-окислителю, столько тот и получил. Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем .
Значит, надо уравнять число электронов в первой и второй полуреакциях. В химии принята такая условная форма записи уравнений полуреакций:
2 Н 2 0 − 2e − = 2Н +I |
|
1 O 2 0 + 4e − = 2O −II |
Здесь числа 2 и 1 слева от фигурной скобки - это множители, которые помогут обеспечить равенство числа отданных и принятых электронов. Учтем, что в уравнениях полуреакций отдано 2 электрона, а принято 4. Чтобы уравнять число принятых и отданных электронов, находят наименьшее общее кратное и дополнительные множители. В нашем случае наименьшее общее кратное равно 4. Дополнительные множители будут для водорода равны 2 (4: 2 = 2), а для кислорода - 1 (4: 4 = 1)
Полученные множители и будут служить коэффициентами будущего уравнения реакции:
2H 2 0 + O 2 0 = 2H 2 +I O −II
Водород окисляется не только при встрече с кислородом . Примерно так же на водород действуют и фтор F 2 , галоген и известный "разбойник", и казалось бы, безобидный азот N 2 :
H 2 0 + F 2 0 = 2H +I F −I |
3H 2 0 + N 2 0 = 2N −III H 3 +I |
При этом получается фтороводород HF или аммиак NH 3 .
В обоих соединениях степень окисления водорода становится равной +I , потому что партнеры по молекуле ему достаются "жадные" до чужого электронного добра, с высокой электроотрицательностью - фтор F и азот N . У азота значение электроотрицательности считают равным трем условным единицам, а у фтора вообще самая высокая электроотрицательность среди всех химических элементов - четыре единицы. Так что немудрено им оставить бедняжку-атом водорода без всякого электронного окружения.
Но водород может и восстанавливаться - принимать электроны. Это происходит, если в реакции с ним будут участвовать щелочные металлы или кальций, у которых электроотрицательность меньше, чем у водорода.
2Н2 + О2 ––> 2Н2О
концентрации водорода, кислорода и воды изменяются в различной степени: ΔС(Н2) = ΔС(Н2О) = 2 ΔС(О2).
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
2.1.1 Кинетическое уравнение химической реакции. Порядок реакции.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + . ––> еЕ + .
можно записать:
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
2.1.2 Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
2.1.3 Реакции первого порядка
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида (II.6). Подставим в него выражение (II.2):
![]() (II.7)
(II.7)
После интегрирования выражения (II.7) получаем:
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:

Рис. 2.3 Зависимость логарифма концентрации от времени для реакций первого порядка
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени (рис. 2.3) и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
![]() (II.12)
(II.12)
Как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
2.1.4 Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
Рассмотрим простейший случай, когда кинетическое уравнение имеет вид (II.14) или, что то же самое, в уравнении вида (II.15) концентрации исходных веществ одинаковы; уравнение (II.14) в этом случае можно переписать следующим образом:
![]() (II.16)
(II.16)
После разделения переменных и интегрирования получаем:
Постоянную интегрирования g, как и в предыдущем случае, определим из начальных условий. Получим:
Т.о., для реакций второго порядка, имеющих кинетическое уравнение вида (II.14), характерна линейная зависимость обратной концентрации от времени (рис. 2.4) и константа скорости равна тангенсу угла наклона прямой к оси времени:
 (II.20)
(II.20)

Рис. 2.4 Зависимость обратной концентрации от времени для реакций второго порядка
Если начальные концентрации реагирующих веществ Cо,А и Cо,В различны, то константу скорости реакции находят интегрированием уравнения (II.21), в котором CА и CВ – концентрации реагирующих веществ в момент времени t от начала реакции:
![]() (II.21)
(II.21)
В этом случае для константы скорости получаем выражение
2. Запишите кинетическое уравнение для реакции: 2Н2 +О2= 2Н2О. 3. Во сколько раз увеличится скорость реакции, если температурный коэффициент равен 3, а температуру увеличили на 30 градусов? 4. При повышении температуры на 40 градусов, скорость реакции возрастает в 16 раз. Определите температурный коэффициент.
Картинка 12 из презентации «Скорость реакции» к урокам химии на тему «Реакции»Размеры: 960 х 720 пикселей, формат: jpg. Чтобы бесплатно скачать картинку для урока химии, щёлкните по изображению правой кнопкой мышки и нажмите «Сохранить изображение как...». Для показа картинок на уроке Вы также можете бесплатно скачать презентацию «Скорость реакции.ppt» целиком со всеми картинками в zip-архиве. Размер архива - 15 КБ.
Скачать презентациюРеакции
«Скорость реакции» - Факторы, влияющие на скорость. Что мы изучали? Влияние концентрации реагирующих веществ (для гомогенных систем) 3ряд. Температура. Чем определяется скорость реакций? 2. Запишите кинетическое уравнение для реакции: 2Н2 +О2= 2Н2О. Присутствие катализаторов или ингибиторов. Решение задач. Катализаторы и катализ.
«Закон сохранения массы веществ» - 1673г. Закон сохранения массы веществ. Индекс. Индекс показывает число атомов в формульной единице вещества. Подобно Бойлю русский учёный делал опыт в запаянных ретортах. 1789г. Общая средняя школа № 36 имени Казыбек би. Роберт Бойль. Коэффициент. 5н2о. 1748г. Химическая формула. Цели урока: Обучающие - экспериментально доказать закон сохранения массы веществ.
«Радиоактивные превращения» - Вехи истории. No–число радиоактивных ядер в начальный момент времени. t–время распада. Закон радиоактивно-го распада. Опыт. Что такое период полураспада? Т–период полураспада. Исследования Резерфорда. Вывод из правил. Атомы радиоактивного вещества под- вержены спонтанным видоизмене-ниям. Предыстория исследований радиоактивности.
«Химические реакции практическая работа» - Ппг. Н2 – Газ, без цвета, запаха, легче воздуха. 4) Черный CuO становится красным, на стенках пробирки образуется H2O. Пробирки. 2)Чистый Н2 взрывается с глухим хлопком, Н2 с примесями- лающий звук. 3kcns+feci3=3kci+fe(cns)3 обмен. AI+HCI. Cu. Zn+H2SO4 = ZnSO4+H2 Замещение. Спиртовка. Наблюдали признаки химических реакций.
«Реакции» - Появления запаха. Дать начальные представления о химической реакции. Выделение газа. Оборудование: Растворы – соляной кислоты и известковой воды, кусочек мрамора. Проверка домашнего задания. Приведите примеры сложных веществ? Роль химии в жизни человека. Образование осадка. Выделение или поглощение теплоты.
«Теория электролитической диссоциации» - Все простые вещества, все оксиды и н/р кислоты, основания и соли. Сванте Аррениус. Вещества в растворах. Вещества с ионной и ковалентной полярной связью. Теория электролитической диссоциации (ТЭД). II-е положение ТЭД. Вещества с ковалентной связью: Ориентация диполей воды?гидратация? ионизация? диссоциация.
Всего в теме 28 презентаций